借鏡COVID-19疫情發展 資策會科法所:應完善我國藥事法專案核准制度
(中央社訊息服務20210520 15:57:35)
COVID-19疫情自去(2020)年爆發至今,已在全球造成上億確診案例,並導致超過300萬人死亡,為防止疫情持續擴散,各國紛紛投入資源,積極研發疫苗及藥物。財團法人資訊工業策進會科技法律研究所(資策會科法所)分析師周晨蕙指出,為加速疫苗審查進度,各國陸續採用緊急使用授權或有條件上市許可等制度,讓疫苗可以儘早投入使用。我國衛福部食藥署應疫情需要,自去年起透過《藥事法》第48-2條及《特定藥物專案核准製造及輸入辦法》(以下簡稱辦法)等規定,專案核准多項藥品、醫材輸入,而AZ疫苗亦於今(2021)年2月透過上開規定核准輸入我國,惟目前辦法只有8條,相較於國外類似制度,仍有進一步完善空間。
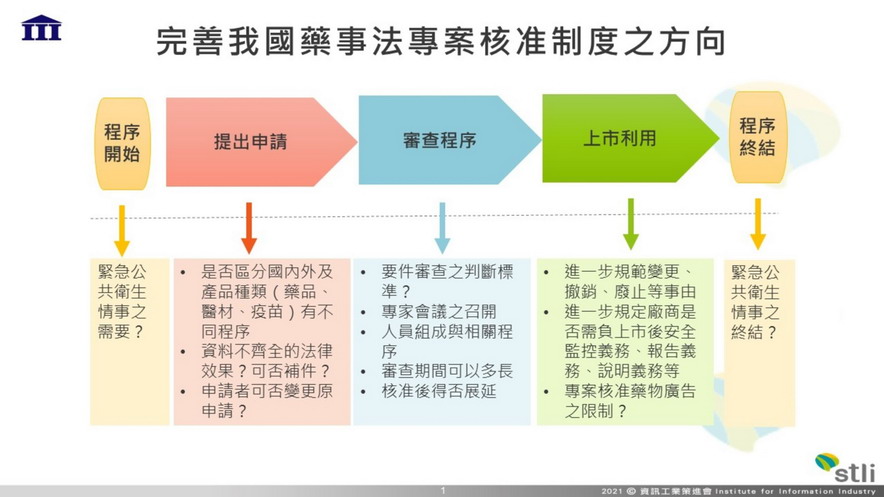
資策會科法所建議我國藥事法專案核准制度可採行之方向
|
|
周晨蕙說明,以特定藥物經專案核准後可要求廠商或醫療機關遵守之義務為例,目前辦法僅於第7條規定得命經專案核准之製造或輸入者於一定期限內,檢送專案核准藥物之安全或醫療效能評估報告,至於其他可能之配套措施,如是否需在標籤上加註警語、是否應採取上市後安全監控措施,以及使用疫苗或藥物前對民眾之說明義務等,則未規範在辦法內。基於上述理由,如主管機關想要求申請人採取一定措施,只能看《藥事法》或其他辦法有無規定,或回歸《行政程序法》第93條,以行政處分附款方式處理。 此外,《藥事法》第48-2條第2項雖允許主管機關遇有特殊情形時,可以廢止核准處分,卻未明示是否可一部廢止;而辦法亦僅於第7條後段規定,逾期未檢送效能評估報告者,中央衛生主管機關得廢止其核准。有鑑於此,若主管機關想保留日後廢止原處分之可能性,只能檢視是否存在《行政程序法》第123條所列情況,依職權全部或一部廢止原處分。 周晨蕙表示,雖然目前主管機關若想要求專案核准之製造或輸入者履行特定義務,或想基於其他理由廢止原先核准之處分時,仍可依照《藥事法》或《行政程序法》等規定辦理,但無論是要求廠商採取相關措施或是廢止核准處分,皆影響廠商和人民權益甚鉅,如能具體明定在辦法中,相信能更加妥善地保護人民權益,在因應緊急情況讓疫苗提早上市之利益和風險間取得平衡。 |
有鑑於此,周晨蕙建議,未來或可參考其他國家有關廢止之事由,及要求申請人應履行之義務等規定,完善我國《藥事法》第48-2條及辦法相關規定,讓主管機關在做出決定時,能依循更加具體且明確的標準。


