簡析自動駕駛巴士應用於我國上路營運所需面臨之法制預備方向

簡析自動駕駛巴士應用於我國上路營運所需面臨之法制預備方向
資訊工業策進會科技法律研究所
2021年05月25日
近年來,世界各國眾多業者積極投入開發自動駕駛車輛(Autonomous Vehicle,下稱自駕車,自動駕駛簡稱自駕)或自動駕駛系統(Automated Driving System,下稱自駕系統),相關應用情境刷新了未來智慧交通的想像。因應技術潮流,各國法規亦陸續針對自駕車應用所涉事物與環境進行系統性的規範與制度整備,以利其情境測試與未來實際應用。
除了前揭世界自駕車應用與法制趨勢潮流,為使我國自駕車相關應用得以順利發展,交通部早在2017年已先行修正道路交通安全規則(下稱道交規則)第20條,並同時新增附件21「自動駕駛車輛申請道路測試作業規定」,以利自駕車應用得進行道路測試;此外,為使自駕技術應用可進一步測試營運情境,故我國後於2018年12月19日公布無人載具科技創新實驗條例(下稱無人載具條例),而行政院於隔年(即2019年)6月1日核定施行該條例及其4項授權辦法,以利相關產業技術與創新服務發展[1],正式開啟了無人載具科技創新實驗沙盒(下稱無人載具沙盒),雖然前開條例之適用範圍不限於自駕車,尚包含航空器、船舶等載具[2],但其中自駕車之相關應用應屬焦點,其中又以自駕巴士應用為我國無人載具沙盒之多數[3],故本文即聚焦就自駕巴士應用上路營運所涉之相關法制進行討論並探究調適方向。
壹、事件摘要
我國無人載具沙盒較多為自駕巴士應用實例,為促使該等應用在沙盒試煉後得順利上路營運載客,以避免銜接實際提供服務落空,宜及早檢視我國法制有無調適必要。
緣自駕巴士似可理解為裝設自駕系統之大客車,則若欲使自駕巴士得於我國道路上進行正式載客服務(非沙盒之實驗),通盤地檢視我國公路法、運輸業管理規則(下稱運管規則)、道路交通管理處罰條例(下稱道交條例)、道交規則等相關規範則有其必要性;自駕巴士之應用亦可能因為自駕技術特徵,藉由系統設置之虛擬軌道,或於環境相對單純之情境下進行載運,而有類同大眾捷運法(下稱大捷法)所稱大眾捷運系統之特性,因此自駕巴士因應實際情境所需之法制,宜分別加以研析。
貳、重點說明
一、自駕巴士之特性與未來可能調適之相關法制
(一)各類自駕巴士應用之特性
我國迄今無人載具沙盒之實例,或得透過使用專用道路與否,歸納、分類自駕巴士未來應用模式,約略為專用道型(類捷運型)、公車型、混用型等三類。
專用道型自駕巴士係指藉特殊的路權設計、實體隔離設施、實際管制措施或其他可分離他種車輛的方式,使其行駛環境達到獨立(或接近獨立)的成效,且因其行駛路線固定並存有隔離其他道路載具之方式/措施,故行駛環境上較為單純而類似現行大眾捷運系統(不論為完全獨立[4] 或非完全獨立[5] ),而與其他巴士應用有別。
公車型自駕巴士顧名思義,或可理解為裝設自駕系統而與其他載具共同行駛於道路之巴士,即便因應自駕技術特性而設計優先相關配套措施(如道路車輛宜禮讓自駕巴士先行等),其仍與現行人駕傳統巴士行駛環境同屬複雜情境,似較無差異。
混用型自駕巴士則指同時具備專用道型與公車型之特徵者,換言之,其行駛環境部分為僅行駛於自駕巴士專用道,另一部分則與其他道路載具共同行駛於道路上。
綜上,此等自駕巴士分類,係藉由陸上運輸載具行駛環境複雜度而劃分,申言之,行駛環境最為單純之大眾捷運系統車輛為光譜的一端,另一端則是公路法及道路交通相關規範之汽車,而各類自駕巴士則分散於光譜上(如下圖)。
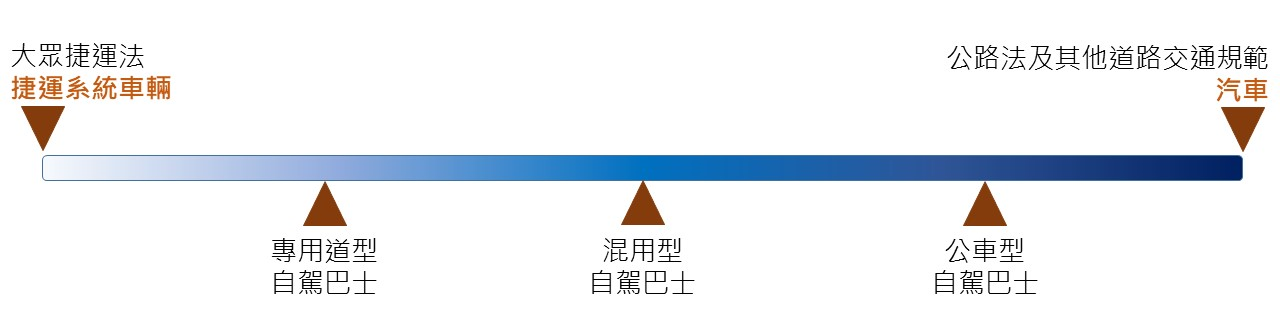
資料來源:本計畫自行整理繪製
圖:各式自駕巴士可能對應之法規體系定位光譜
(二)因應自駕巴士類型而可能調適之相關法制
承上,自駕巴士因為不同的應用情境,而在行駛環境的光譜上有相對應的位置,而傳統巴士係依循公路法、運管規則、道交條例、道交規則及其他道路交通相關規範進行整體性的法制監管,或將因自駕技術引入而有不同。
公車型與混用型自駕巴士,有高度與一般道路載具共用道路的情境,行駛環境如傳統巴士般複雜,故對其等之監管、管理方向依循現有巴士(大客車)運輸體制似無不妥;不過,專用道型自駕巴士則有所不同,其行駛環境上可藉由相關措施,達到現行大捷法所示大眾捷運系統之單純行駛環境,甚有期許此類自駕巴士應用可跳脫傳統巴士制度框架,而往大捷法較為彈性之方向適用[6]
另外,除了以我國現行規範檢視專用道型自駕巴士未來可能適用之法制外,觀察國際上接近台灣整體環境,且在自駕車整體發展(法制、技術發展、基礎建設、公眾接受度綜合評比)較為突出的新加坡[7] ,其看待自駕車(包含自駕巴士)之適用法制途徑,係從陸路交通法(Road Traffic Act)第6C條、第6D條授權交通部長(Minister for Transport)訂定2017年陸路交通(自動駕駛機動車輛)規則(Road Traffic Act (Autonomous Motor Vehicle) Rules 2017),使陸路交通管理局(Land Traffic Authority)得就自駕車應用之相關使用、測試進行准駁及其他行政監管,即便為專用道型自駕巴士試驗,迄今似乎尚無依循該國類同我國大捷法之快速運輸系統法(Rapid Transit Systems Act)之趨勢。
綜上討論,或可推知不論何種類型之自駕巴士,依我國現行規範體系下,均宜從我國公路法及道路交通相關規範開展與適用,不過即便如此,仍不可忽視各類自駕巴士應用均有其特殊性,如同行駛環境複雜度的光譜上即有不同的結果,則在相關制度建置上宜分別檢視不同類型之需求而思考規範的未來方向,舉例來說,專用道型自駕巴士應用情境不一定均符合大捷法第3條第1項所示大眾捷運系統之要求─「導引之路線」、「使用專用動力車輛」、「密集班次」、「大量快速運輸」等,但未來仍可因行駛環境單純之特性,透過其他方式調適、參照(如設立專章規範、就特殊事項準用等)較為彈性之大捷法規範模式。
二、調適各類自駕巴士所涉法制可能之思考方向
接續前述有關自駕巴士於我國法制適用上的討論,下個將面臨的問題即是將調適哪些法制環節,方可使自駕巴士相關應用可於我國順利營運、提供服務,就此,或可先循以下三大面向進行思考。
(一)環境建置─路權與路側設施
1.路權
「路權」一詞是俗稱用來簡易表達車輛行經處之優先性。在理解上,參照大捷法第3條第2項、交通部之部頒規範─輕軌系統建設及車輛技術標準規範1.3名詞解釋(雖然該等規範係因應大眾捷運系統而為之解釋與分類),路權大致可分為專有、隔離與共用等三種路權形式。
考量自駕巴士之各式應用情境,仍有部分優先之路權規劃需求,以目前現行交通相關法制來說,似可參照市區道路條例第32條第1項及該條項授權訂定之市區道路及附屬工程設計標準第5條第4款、發展大眾運輸條例第5條及同條授權訂定之大眾運輸使用道路優先及專用辦法等規定,由地方政府視在地需求設置適切的巴士專用、優先等相關設施。不過特別宜予注意的是,對於專用道型自駕巴士而言,雖然此等規範似可使其在各地進行設置相應的設施,但實際上專用道型自駕巴士因其應用特性(達到行駛環境類同大眾捷運系統,並降低人力介入可能性),可能更需要全國統一性的設置標準與要求,以維乘客以及其他用路人之權益,故就此或可考量使此類自駕巴士得參考大捷法規範模式,另行建立並遵循其專屬之技術標準規範,並於其中明文有關專用道設置之相關事項。
2.路側設施─以攝錄影、感測器等設備為例
為使自駕技術應用於巴士旅客運輸可更為安全,作為輔助自駕系統作動之相關路側設施似有其必要性,其中又以攝錄影與感測器等設備為首要。
以攝錄影設備而言,在我國現行法制上,或許可以藉由公路法第79條第1項授權訂定之公路用地使用規則第15條予以規範,其中雖未明文攝錄影設備,但以架設之便利與普遍性而言,似可透過路燈桿柱建置比擬,並由中央或各地方政府[8]衡酌在地需求設置必要之自駕巴士應用所需之攝錄影設備,但仍須注意該等設備所蒐集、處理或利用之影像與民眾隱私權之平衡,除非有具體明確的應用目的與其他法律授權,否則不宜將該等影像用於自駕巴士以外之應用。
至於自駕巴士應用可能涉及之感測器設置,由於其與道路號誌變化息息相關,如以現行較為接近之法令,似可參照道交條例第4條及同條授權訂定之道路交通標誌標線號誌設置規則(下稱設置規則)、市區道路條例第32條第1項及同條項授權訂定之市區道路及附屬工程設計標準第26條等規定,將之解為道路號誌其他相關設施。不過,感測器應用不僅止於影響道路號誌者,未來更可能與整體(自駕巴士)車聯網介接而互動,故如要完善整體感測器設置,似有調適前揭規範或另行補足之空間。
然而,前述討論均係奠基各類自駕巴士依循公路法及道路交通相關規範之視野,但誠如前述,專用道型自駕巴士若可參照大捷法之規範模式,則可依循另行建立專屬之技術標準規範,並於其中明文整體專用道型自駕巴士可能涉及之路側設施要求與設置基準。
(二)車輛與自駕系統之於道路上運行之要求與規範
按公路法第63條之規定,汽車應符合交通部之安全檢驗標準,並經車輛型式安全檢測及審驗合格,取得該證明書方可登記、檢驗及領照,而各類自駕巴士依我國現行法制而言,尙屬大客車之範疇,自應循前述規範檢驗合格,方可登記、領照上路,否則可能有道交條例第12條之責任,更可能導致車輛因此遭沒入。據此,未來如欲使各類自駕巴士於我國正式上路運行,宜將自駕系統相關功能、特徵等新增至車輛安全檢測基準[9],以利自駕巴士上路提供運輸服務。
此外,除了前述關於車輛、自駕系統的認證外,自駕車(或自駕系統)是否得在道路上運行其自駕功能,以現行公路法及道路交通相關規範等法制係以人力駕駛車輛作為前提,似乎有所扞格,因此,如要解決此等困境,或宜通盤性檢視整體法制有何須因應自駕系統可能於道路上運作而調適之規範,如:駕駛人雙手離開方向盤可能構成到交條例第43條第1項第1款所稱之其他危險方式駕車,以利自駕車(包含自駕巴士)未來可順利上路。
不過,由於專用道型自駕巴士相較其他二類,行駛環境單純許多,似可想像突發狀況產生而帶來的風險較低,故相關車輛要求或可參照相對較有彈性之大捷法規範模式,依循另行建立專屬之技術標準規範,並於其中明文專用道型自駕巴士之車輛相關安全、功能、技術基準。
(三)駕駛(操作)人員之資格、行政監管
依現行道交條例第21條至第22條,以及同法第92條第1項授權訂定之道交規則等規定,取得相對應或適切之駕駛執照(下稱駕照)者方得駕駛該類別之車輛,否則可能須負擔相應之行政罰責任[10],且駕照之考取有相對應之年齡、經歷、體格、體能、筆試、路考或其他不得具備之條件等要求[11]。各類自駕巴士之駕駛(操作)人員操控此類大客車,原則上仍須適用我國現行法制,甚至在車輛得完全自主運作行駛前,此等人員似宜具備一定操縱車輛之能力與資格,以利乘客與整體交通等安全維護;不過,未來自駕技術如能發展至可在任何情況下均可安全操控車輛,則前揭相關人員的條件、要求或有調整、放寬的可能及必要性。除此之外,自駕技術之引入,可能相當程度上降低人力操控車輛的負擔,故自駕巴士之駕駛(操作)人員有關執行勤務的要求(此為勞動基準法以外之特別規定)[12]、高齡對勤務的影響[13]等,亦似有檢討而放寬的可能性。最後,公路法及道路交通相關規範之體制,對於車輛操作與駕駛,目前仍是以「人力駕駛」作為規範、監管主體,未來自駕車(包含自駕巴士)正式於我國上路提供服務時,宜通盤性檢視與思考相關行政監管要求,如何因應人力駕駛逐漸轉為自駕系統操控車輛。
然而,由於專用道型自駕巴士與其他二類型態相比,行駛環境單純而突發狀況較為稀少,對於人員的資格、培訓與監管等要求似彈性化的可能,據此,或可使此類自駕巴士參酌大捷法較具彈性之原則性規定(如:該法第30條、第42條、第53條)以及相關子法規範,由直轄市或縣(市)政府對行車人員[14]進行有效之訓練與管理,並對其技能、體格與精神狀況進行定期或臨時檢查並記錄,且可派員查核或對行車人員進行臨時檢查[15],如有不合標準者,則應暫停或調整職務,更須於辦理訓練前將計畫報請直轄市或縣(市)政府核備,事後再將成果報請備查[16]。
參、事件評析
隨著無人載具沙盒實驗的進展,自駕巴士於我國上路載客營運之應用情境與景象愈發清晰,自駕巴士運輸或係自駕車載人應用模式最有可能優先實現的樣態。為避免我國相關法制與技術、產業等進展速度無法契合,故自駕巴士上路所涉相關法制預備有其必要性。
如依循自駕巴士行駛環境之複雜度進行區分,並由單純至複雜排列,或可將其等劃分為專用道型、混用型、公車型等自駕巴士,各類情境均有其特殊性,不過仍可大致分成環境建置、車輛要求、人員(資格)監管等面向,思考如何因應自駕技術導入後的影響,循前述我國現行道交條例等既有規範架構及有關規定,預作法制調適。不過,專用道型自駕巴士較類同大眾捷運系統,行駛環境較為單純,除了自駕技術可能帶來的放寬或彈性規定外,更有可能參酌大捷法相關較為彈性、靈活的規範方式。
[1]〈無人載具科技創新沙盒─緣起〉,無人載具科技創新沙盒,https://www.uvtep.org.tw/plan(最後瀏覽日:2021/05/05)。
[2]無人載具科技創新實驗條例第3條第1款。
[3]〈無人載具科技創新沙盒─資訊揭露〉,無人載具科技創新沙盒,https://www.uvtep.org.tw/approved(最後瀏覽日:2021/05/05)。
[4]相關應用情境,可參:蔡文居,〈台南捷運系統重大變革 高架自駕系統後來居上〉,自由時報,2020/05/21,https://news.ltn.com.tw/news/Tainan/breakingnews/3173006(最後瀏覽日:2021/02/27);蔡文居,〈捷運系統擬推高架自駕 採虛擬軌道〉,自由時報,2020/05/22,https://news.ltn.com.tw/news/Tainan/paper/1374364(最後瀏覽日:2021/05/07)。
[5]相關應用情境,可參:〈台北市信義路公車專用道自駕巴士創新實驗計畫〉,TURNING,https://turing-drive.com/%E5%8F%B0%E5%8C%97%E5%B8%82%E4%BF%A1%E7%BE%A9%E8%B7%AF%E5%85%AC%E8%BB%8A%E5%B0%88%E7%94%A8%E9%81%93%E8%87%AA%E9%A7%95%E5%B7%B4%E5%A3%AB%E5%89%B5%E6%96%B0%E5%AF%A6%E9%A9%97%E8%A8%88%E7%95%AB/(最後瀏覽日:2021/05/07)。
[6]蔡文居,前揭註4。
[7]KPMG, 2020 Autonomous Vehicles Readiness Index (2020), https://assets.kpmg/content/dam/kpmg/xx/pdf/2020/07/2020-autonomous-vehicles-readiness-index.pdf (last visited May 10, 2021).
[8]參公路用地使用規則第4條所示各公路主管機關之權責。
[9]未來調適之方向與內容,或可參聯合國歐洲經濟委員會(United Nations Economic Commission For Europe, UNECE)世界車輛法規調和論壇(World Forum for Harmonization of Vehicle Regulations,簡稱WP. 29)、美國國家交通安全管理局(National Highway Traffic Safety Administration,即NHTSA)訂定之相關車輛安全標準、自駕系統功能以及其他車輛要求等內容,以利我國車輛型式安全檢測及審驗得與時俱進。
[10]道路交通管理處罰條例第21條、道路交通安全規則第50條第1項、第61條、第61條之1。
[11]參道路交通安全規則第52條至第70條。
[12]汽車運輸業管理規則第19條之2。
[13]汽車運輸業管理規則第19條之7。
[14]如臺北市大眾捷運系統行車人員技能體格檢查規則第3條、高雄市大眾捷運系統行車人員技能體格檢查規則第3條、新北市大眾捷運系統行車人員技能體格檢查規則第4條,行車人員包含運務人員以及維修人員。
[15]大眾捷運系統經營維護與安全監督實施辦法第14條。
[16]大眾捷運系統經營維護與安全監督實施辦法第11條。
美國雖將能源列為國家長期的能源政策目標,自1990年代後期,亦投入核能的安全性、環境建置及研發補助等,但最近因將重點放在其他替代性能源的開發,因此在核能方面的計畫稍微減少,尤其自1979年美國三哩島核電廠(Three-Miles Island Nuclear Generating Station)發生事故後,美國三十年來未再興建任何核電廠。但由於核能發電的高效率與不會排放二氧化碳的低污染,因此美國政府將之列為重點發展項目,強調美國政府的能源政策是要發展任何可能的能源,包括合核能,以提升在全球潔淨能源的競爭優勢。 美國總統歐巴馬表示,為了維持能源供需的穩定,以及避免氣候的惡劣變遷,有必要重啟美國核能產業,持續提高核能的供應量。因此於2011年12月經核子管理委員會(Nuclear Regulatory Commission)通過、2012年2月再次於投入核電廠的興建,於喬治亞洲Vogtle核電廠核准興建兩座新的核能反應爐,並透過成本分擔協議(cost-share agreement)投入2億美元,協助設計認證及許可。 此外,並於同年3月宣布投入4. 5億美元於五年內支持兩座自製的小型核能反應爐(small modular nuclear reactor,SMR)的設計、認證及核准,希望能輸出這些自製的反應爐,提升全球潔淨能源的競爭力。這些反應爐約只佔核能廠的三分之一面積,具有安全的建築設計,小型反應爐能在工廠內製造,並運輸到定點安裝,能節省成本及建造的時間。且其最理想的地方在於其體積小,能使用在小型智慧電網級一些無法容納大型反應爐的地方,其運用能更有彈性,能增加經濟效益。 國政府希望透過與私人企業的合作,帶領美國在全球核能科技及製造的領先地位。因此希望能源部希望此計畫能經核子管理委員會的許可,此一小型核能反應爐的計畫總金額為9億美元,透過與私人企業成本分擔的協議,其中50% 由國會撥款,另50%則由私人企業投資,並於2022年商業化,取得在全球潔淨能源的競爭優勢地位。
英國4G釋照近況在經歷1個多月、共50回合4G(含LTE與Wimax)頻譜拍賣後,英國Ofcom在2月20日宣布Everything Everywhere Ltd(EE)、 Hutchison 3G UK Ltd、 Niche Spectrum Ventures Ltd、 Telefónica UK Ltd (O2)與Vodafone Ltd五家公司取得頻譜執照。這次4G釋照拍賣收入比預期少10億英鎊,但也挹注英國政府23.4億英鎊,使財政得以紓緩。目前,英國民眾最晚於2017年,就可享有更快、更便宜與覆蓋性更佳的4G服務。 此次頻譜釋出共有250MHz取自於800MHz與2.6GHz。800MHz之得以釋出,來自於類比電視訊號關閉後,因頻譜重整所取得之「數位紅利」,並採取分頻多工(frequency division duplexing,FDD);至於,2.6GHz則依頻段不同,而分別採用分頻多工與分時多工(time division duplexing,TDD)。由於,800MHz擁有優良覆蓋性,是故,英國政府藉由800MHz特性,釋放一張2*10MHz之執照,並規定業者覆蓋義務,以達到英國發展行動網路之目標。目前,取得該執照的O2,最晚於2017年須提供98%人口於室內可取得行動寬頻服務、至少95%人口能於英國境內(英格蘭,北愛爾蘭,蘇格蘭和威爾士)取得4G服務。 在Ofcom採取組合價格鐘拍賣型式(combinatorial clock auction,CCA)下,目前,業者已完成頻譜標得區塊數目(Eg:EE於800MHz取得一張2*5MHz),待得標者完成配置(Assignment stage)頻段位址(Eg:EE頻段確定在800 MHz ~805 MHz),最快於2013年夏天,英國民眾可更普及的享有下述優點: 1.網速可達到100Mbp,超越現今3G五至十倍。 2.使用智慧型手機、平板觀看電視,雜訊、遲緩的問題將不復見。 3.使用高畫質視訊將更為輕鬆,並且,照片與影片上傳於社群網站將非常迅速。 4.偏遠地區可因4G的覆蓋性廣而具有網路服務。 OFCOM不僅促進4G市場競爭外,並在今(2013)年年底提供報告,告知消費者與企業4G服務發展現況、地理位址,與網路速度,讓使用者有能力作出最好的選擇。而在未來的發展上,許多研究單位估計2030年時,行動網路的傳輸需求將可能是現在80倍,英國亦開始探討釋出頻譜發展5G的可能性,以因應未來供不應求所導致的「容量危機」(capacity crunch )。
美國寬頻進步報告:寬頻部署有顯著改善但數位落差持續存在根據美國聯邦通訊傳播委員會(Federal Communications Commission, FCC)於2016年之寬頻進步報告,美國現行之標準為業者必須提供下載速度至少達25Mbps與上傳速度至少達3Mbps之寬頻服務,相較於2010年所設立之標準─下載速度至少達4Mbps與上傳速度至少達1Mbps的寬頻服務,顯示出美國在寬頻部署上有明顯的進步。然而,目前仍有3400萬美國人民所使用之寬頻服務並未達到上述FCC所設立之標準(25Mbps/3Mbps)。 這份報告亦顯示,持續之數位落差(digital divide)導致40%生活在鄉村以及部落地區之人民所使用之寬頻服務並未達到上述FCC所設立之標準(25Mbps/3Mbps)。此外,E-rate計畫方案之持續推行,雖使許多學校之網路連線已有顯著改善,但仍有41%之學校未能符合FCC之短期目標,亦即這些學校之寬頻連線仍無法供應數位學習之應用。基於以上理由,2016年之寬頻進步報告總結:寬頻部署並未被適時並合理的(timely and reasonable)適用於全體美國人。 該份報告亦認為當今的通訊服務應以固網及行動寬頻服務(fixed and mobile broadband service)之方式提供,彼此的功能不同並能互補。然而,FCC尚未建立行動寬頻服務標準,因此,行動寬頻之部署尚未能反映在目前之評估。 依據1996年電信法第706條之規定,FCC必須每年報告先進通訊能力之部署,是否讓每位美國人民都能適時且合理的使用。國會所定義之「先進通訊能力」(advanced telecommunications capability)必須具高品質之能力,可讓使用者傳輸以及接收高品質之聲音、數據資料、照片以及影像服務。 此份報告重點總結如下: ●全面部署: 目前仍有3400萬美國人(約10%人口)無法接取固網下載速度至少達25Mbps與上傳速度至少達3Mbps之寬頻服務。然而,相較於去年之5500萬美國人(約17%人口)未能接取該寬頻服務,今年已有顯著的改善。 ●鄉村與城市間之數位落差仍待改善: 仍有39%之鄉村人口(2340萬人)以及41%之部落人口(160萬人)無法接取該寬頻服務(25Mbps/3Mbps)。相較於都市僅有4%之人無法接取該寬頻服務,發展上仍不平等。但相較於去年報告所示,有高達53%鄉村人口以及63%部落人口無法接取寬頻服務,城鄉發展不均之程度已有改善。 ●學校之寬頻速度: 全國僅有59%之學校達到FCC所設立之短期目標,亦即100Mbps可以供1000位學生使用,並有極少數之學校達到長程目標,即1Gbps可供1000位學生使用。 這份報告首次將衛星寬頻服務列入評估,FCC對於衛星寬頻服務適用與固網寬頻服務採用同樣之標準(25Mbps/3Mbps)。然而,在評估過程中,尚未有任合衛星寬頻服務符合FCC所採行之寬頻標準。
德國完成800MHz頻譜重分配德國電信監理機關Bundesnetzagentur (BNetzA)於2010年5月宣告完成包括800MHz、1.8GHz、2GHz和2.6GHz等多頻帶中共計41塊頻段的頻譜拍賣,成為歐洲第一個完成數位紅利頻譜重分配的國家。 本次拍賣主要由四個行動營運商(E-Plus、T-Mobile、Vodafone、O2)參與投標,歷經224回合競標,挹注政府約43.8億歐元收入,遠低於之前預估的80億歐元,也遠低於10年前的3G頻譜500億歐元。 只有三家業者(T-Mobile、Vodafone、O2)取得數位紅利800MHz頻譜使用權;未得標的E-Plus公司則早已表達意願,將租用其中一個得標者的新網路頻寬,以使用數位紅利。 本次拍賣並沒有產生新的市場參進者,此狀況讓那些希望開放新頻譜即可刺激新的市場競爭的人頗為失望。惟BNetzA以為,目前市場上已經有約100家的MVNO業者和為數眾多的次品牌服務經營者在競爭,監管機關看不出應執行拍賣條款中「應有利新的市場參進者」的理由。 市場主導者T-Mobile已經宣稱,將率先於今年開始利用800MHz測試發展LTE服務。但由於在800MHz段部署LTE網路將與歐洲其他國家(主要指TeliaSonera公司在瑞典和挪威)早先同意於2.6GHz佈建的網路技術有異,而在密集的城市環境中,在800MHz與2.6GHz頻段同時部署LTE被視為是相當理想的網路佈建策略,歐盟現階段正在想辦法調和兩個頻段的和諧使用策略中。



