太空經濟浪潮下的太空製造零組件出口策略

太空經濟浪潮下的太空製造零組件出口策略
資訊工業策進會科技法律研究所
2025年05月06日
2025年上半,隨太空研發實戰活動開跑,新年度的太空供應鏈整備工作及人培活動承接過往成果,開始積極推動[1]。隨近年各國搶進太空經濟領域,我國政府亦善用台灣現有晶片元件技術優勢及民間製造業能量,協助我國太空製造業及衛星射頻零組件製造廠商參進國際太空產業供應鏈,期許創造出口順差並提升台灣的國際經濟地位。惟與其他傳統產業相較,太空產業高速發展之時間尚短,尚未形成完善的國際貿易網絡及相關協定,且所屬市場受各國技術及進出口法制整備情況所限,推動相關產品進出口時,仍有眾多議題待處理和釐清。
壹、推動太空射頻零組件出口策略
我國太空製造業者、衛星射頻零組件製造廠商於晶片元件領域具有明顯技術優勢。近年來,我國業者為搶占國際市場,積極發展與重要衛星營運商、各國業者間之貿易關係。然目前各國對於射頻器材進口,多設有審驗管控及品項限制規定,使我國衛星射頻零組件製造廠商於出口、貿易過程中,負擔繁重程序成本。
前揭情況下,政府若期許協助我國廠商將產品輸出他國,或協助我國廠商切入各大衛星營運商供應鏈,透過國際協定、約定及類似貿易機制,降低我國廠商將產品輸出他國之驗測、程序成本,應為第一要務。而電信設備互認協議(Mutual Recognition Agreement)即為目前國際間,降低射頻器材進出口驗測、程序成本之重要協議之一。
一、一般射頻器材進口及審驗機制
我國電信管制射頻器材依據對電波秩序之影響程度,區分為第一級、第二級。第一級包含公眾電信網路設置使用之無線發射或收發設備、供專用電信網路設置使用之無線發射或收發設備等四項,第二級則包含無線電信終端設備、有線電話無線主副機、天線直徑三公尺以下之固定衛星地球電臺、行動衛星地球電臺等八項。依據不同層級,進行進口核准證申請時,應備妥不同文件。惟無論為第一級、第二級電信管制射頻器材,進口我國後皆須進行測試、審驗(認證)。具體流程如圖一。[2]

圖一 電信管制射頻器材測試審驗流程
資料來源:詹中耀,〈淺談電信管制射頻器材審驗及後市場管理〉,《NCC NEWS》,第19卷第1期,頁2-3(2025)。
通常情況下,預估於我國銷售之電信射頻設備,測試、審驗(認證)程序多於我國進行。此慣例亦常見於各國廠商進出口業務,以確保設備符合進口國或銷售國法規要求。惟於廠商而言,於他國推進繁複測試、審驗(認證)程序,所需耗費之倉儲、物流、人力、行政成本高昂。此情況雖有助於電信射頻設備安全與市場管理,惟不利於貿易效率。為調適前揭有礙貿易之困境,眾多國家開始積極促進電信設備互認協議(Mutual Recognition Agreement)關係之建構。
二、電信設備互認協議(Mutual Recognition Agreement)運作機制
1998年亞太經濟合作會議(Asia-Pacific Economic Cooperation, APEC)旗下電信及資訊工作小組通過電信設備合格互認協議(The APEC-TEL Mutual Recognition Arrangement, APEC TEL MRA),並於1999年正式實施。該協議主要目標在於簡化APEC成員國進行電信設備貿易時的測試和核准流程,降低貿易壁壘及市場進入障礙,範圍囊括所有受電信法規規範的設備,包含應用於電信功能的有線與無線設備、地面與衛星設備等。[3]
電信設備互認協議的實施方式,是由各協議簽署國自願約定。由約定國業務主管機關,提出電信設備合格測試實驗室或認證機構名單,並經他方約定國認可。經認可後,若電信設備出口至他方約定國前,已在本國受認可實驗室測試或認證機構認證,出口時,即無需在他方約定國複行測試或認證程序。[4]
考量各國測試、認證機構技術與標準之差異,並因應各國貿易政策限制,目前電信設備互認協議下之相互承認模式區分為二類型。其一是測試結果之相互承認,意即二國有互相認可之測試實驗室,約定互相承認測試報告。電信設備自一國出口至另一國時,若已在出口國受認可實驗室進行測試,設備輸入時,即可直接進行認證程序,不必再行測試。[5]
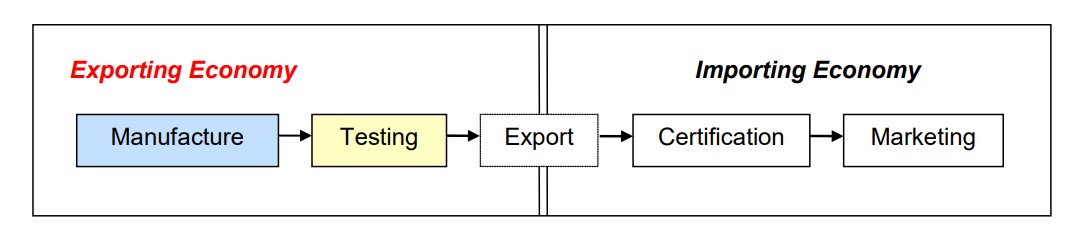
圖二 Phase I of the MRA
資料來源:Asia-Pacific Economic Cooperation Telecommunications & Information Working Group [APEC TELWG], A Guide for Industry to the APEC TEL Mutual Recognition Arrangement (3rd Edition), 1, 6, APEC#201-TC-01 (2015).
其二為認證結果之相互承認,意即二國不僅有互相認可之測試實驗室,更有互相認可之認證機構。電信設備自一國出口至另一國時,若已在出口國通過受認可認證機構之認證,設備輸入時,即可逕為銷售。[6]
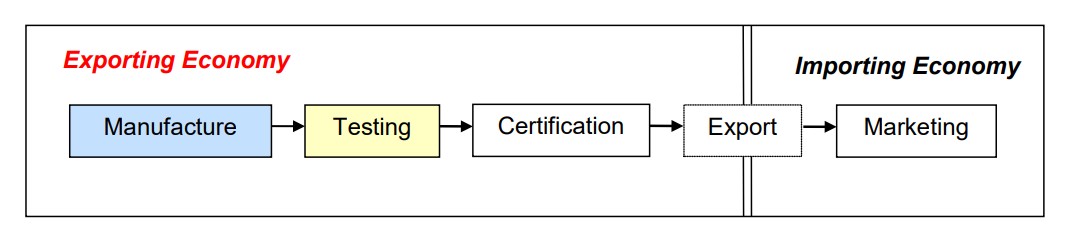
圖三 Phase II of the MRA
資料來源:Asia-Pacific Economic Cooperation Telecommunications & Information Working Group [APEC TELWG], A Guide for Industry to the APEC TEL Mutual Recognition Arrangement (3rd Edition), 1, 6, APEC#201-TC-01 (2015).
貳、協議關係建構流程
通常情況下,與一國約定實施電信設備互認協議之程序分為三大階段。其一,是確認雙方皆為APEC會員國,並曾簽署電信設備互認協議。該協議為多邊協議,非與特定國簽署,而是多國共同承諾參與。於此階段,該協議僅為形式承諾,對各簽署國並無實際執行效力。而待確認兩國同為簽署國後,即可進一步商討雙方是否有意願在電信設備互認協議框架下,約定實施實質上的測試報告、認證結果互認約定。
其二,兩國先依一般國際協議簽訂程序與雙方外交主管機關接觸,確定雙方合作意向。確定意向後,接洽兩國電信設備產業主管機關接觸,進入具體之約定流程。如兩國需協商、起草具體之約定內容,包含互相承認測試報告之細節、兩國實驗室申請認可標準等。
於此階段,兩國電信設備產業主管機關不僅需彼此協商,更需彙整本國利害關係人意見,如相關政府部門、業者與產業公會、消保團體、測試或認證機構、專家之建議,以確保在起草具體之約定內容時,為本國爭取最大利益[7]。同時,兩國主管機關亦將開放各方單位申請為受認可實驗室或認證機構,並將申請通過之名單,提請對方國家之主管機關認可。一旦對方國家認可,未來該實驗室或認證機構出具之結果,將受對方國家承認。
申請為受認可實驗室或認證機構之時點,不必然限於電信設備互認協議關係協商建構期間。依我國目前申請機制,但凡有意願成為受認可實驗室之單位,可隨時函請NCC協助辦理,以成為任一我國電信設備互認協議約定國認可之實驗室[8]。依目前辦理流程,應備文件包含APEC TEL MRA符合性評鑑機構(測試實驗室)指派聲明書、認證證書測試範圍異動前後對照表、財團法人全國認證基金會中英文認證證書等。而若欲申請美國、加拿大認可,則另須提供經全國認證基金會案件承辦人簽註之技術查檢表。[9]
其三,為最終之外交談判與約定,意即與對方國家談判,確定是否認可彼此提出之實驗室、認證機構名單,並確定所有互認協議約定細節,包含約定囊括之設備種類、約定生效時間等。待雙方皆無疑義,達成約定並通過各國國內立法程序,整體約定程序即完備。未來兩國設備出口對方國家前,已於本國通過受認可實驗室測試、認證機構認證者,即不需於對方國家再行測試或認證,可直接銷售。
參、協議排除情境
若欲免除約定電信設備互認協議之繁雜程序,並期許設備出口他國時免除測試、認證等流程,以降低成本,應可考察設備輸入國是否有豁免特定設備測試、認證之規範或政策。各國之規範、政策各有其差異。如加拿大對於供研發測試、組裝後專供輸出之電信設備、低功率射頻設備、無線電話家庭系統設備有豁免之規定。韓國對於供研發測試、組裝後專供輸出之電信設備亦有豁免規定。日本則規定除了非商用設備外,電信設備進口一律需經認證。[10]
肆、政策建議
近年衛星通訊成為電信產業發展之新興趨勢之一,衛星通訊領域電信設備之進出口,亦成為各國約定實施電信設備互認協議時關注的重點。我國作為科技製造產品之重要出口國,近年積極促進衛星通訊設備輸出,並同時已與部分國家為電信設備互認協議之約定[11]。惟目前互為約定之國別尚少,為趕上衛星通訊網路帶來的新一波經濟浪潮。我國應可在徵集各方利害關係人意見後,持續建構我國與其他友好國家之電信設備互認協議約定。
而為進一步強化電信設備互認協議之效益,我國應可進一步積極鼓勵有能力進行衛星電信射頻設備測試之實驗室,申請成為電信設備互認協議關係下之受認可實驗室,或鼓勵業界廠商持續發展衛星電信射頻設備領域之驗測能力。期許透過前揭建議,得以降低我國衛星電信射頻設備製造商出口產品前之驗測成本和驗測排程壓力,為我國廠商創造更多參進他國市場、切入國際供應鏈的可能性。
[1]訊息公告,太空產業供應鏈暨網通產業新星飛揚計畫,https://www.satcom.org.tw/zh-tw/bulletin (最後瀏覽日: 2025/04/21)。
[2]詹中耀,〈淺談電信管制射頻器材審驗及後市場管理〉,《NCC NEWS》,第19卷第1期,頁2-3(2025)。
[3]APEC-TEL MRA, Asia-Pacific Economic Cooperation, https://www.apec.org/groups/som-steering-committee-on-economic-and-technical-cooperation/working-groups/telecommunications-and-information/apec_tel-mra (last visited Apr. 21, 2025);Asia-Pacific Economic Cooperation [APEC], A Guide for Conformity Assessment Bodies to the APEC TEL Mutual Recognition Arrangement (3rd Edition), at 1, 3, APEC#201-TC-03(2015).
[4]Asia-Pacific Economic Cooperation Telecommunications & Information Working Group [APEC TELWG], Mutual Recognition Arrangement for Conformity Assessment of Telecommunications Equipment (1st Edition), 1, 7-15, 22-31, APEC#202-TC-01 (2002).
[5]Asia-Pacific Economic Cooperation Telecommunications & Information Working Group [APEC TELWG], A Guide for Industry to the APEC TEL Mutual Recognition Arrangement (3rd Edition), 1, 6, APEC#201-TC-01 (2015).
[6]id.
[7]APEC-TEL MRA, Asia-Pacific Economic Cooperation, https://www.apec.org/groups/som-steering-committee-on-economic-and-technical-cooperation/working-groups/telecommunications-and-information/apec_tel-mra (last visited Apr. 21, 2025).
[8]我國目前已與五國(或地區)為約定,分別為美國、加拿大、澳洲、新加坡、香港。
[9]林怡萱,〈我國參與亞太經濟合作電信設備符合性評鑑相互承認協定(APEC TEL MRA)之緣起與發展〉,《NCC NEWS》,第19卷第1期,頁15(2025)。
[10]財團法人台灣經濟研究院,〈國際上對非成品射頻器材管理規定及國內廠商對進口研發測試或組裝後輸出器材類別意見委託研究採購案-期末報告〉,國家通訊傳播委員會委託研究,頁312-365(2019)。
[11]Asia-Pacific Economic Cooperation ICT Conformity Assessment and Interoperability Steering Group Meeting, Mutual Recognition Arrangement for Conformity Assessment of Telecommunications Equipment Participation and Implementation Chart, 1, 2023/SOM2/TEL68/CISG/003 Agenda Item: 2 (2024).
原預計於2017年3月2日生效實行的美國聯邦通訊委員會(Federal Communication Commission,FCC)的寬頻客戶隱私規定(Broadband Consumer Privacy Rules),委員會於2017年3月1日宣布暫停該規範效力,並與聯邦貿易委員會(Federal Trade Commission,FTC)發表共同聲明。 為保障資料安全(data security),聯邦通訊委員會於2016年10月27日,以寬頻網路服務提供者(broadband Internet Service Providers,ISPs)及其他電信營運商為規範對象,要求須給予客戶有更多選擇去決定自身資料如何被分享和使用,除將ISP所蒐集得使用及分享的資料分為三類,建立客戶同意要件,尚設立新的提醒要件及保密性違反之通知等。該新的隱私規範試圖與聯邦貿易委員會的規範做區隔,除管制對象不同,管制架構上,聯邦貿易委員會要求業者在蒐集及利用個人資訊時,須符合公平資訊實施原則(Fair Information Practice Principles,FIPPs)之準則(guidelines):通知(notice)、選擇(choice)、讀取(access)、安全(security)。 通過之際產生的爭議,包含聯邦通訊委員會有無管制權限,及實行後可能與聯邦貿易委員會管制架構並行而造成疊床架屋、混淆大眾等的問題;此外,聯邦通訊委員會收到眾多請願,要求重新考慮該規範之實行。請願理由在於該規範之實行將會造成寬頻網路服務提供者及其他電信營運商為了要遵循規範將承受巨大的成本與負擔,並且這些成本與負擔與公眾利益相違背,將會造成不可回復的損害。 在接受請願討論後,聯邦貿易委員會做出暫停實施的決定,認為有關保護資料安全的規範要件需要重新思考,其理由在於:(1)消費者若受到兩種不同的隱私管制方式,會破壞消費者對於線上隱私安全一致性的期待;(2)不應使寬頻網路服務提供者及其他電信營運商遭受重大且不必要的遵循成本。 聯邦通訊委員會也與聯邦貿易委員會共同發表聲明,其聲明提及:聯邦通訊委員會與聯邦貿易委員會皆有責保護美國消費者的線上隱私,然而最好的管制方法,應該是透過一個全面性且一致性的架構。資訊隱私之保護不應當有因管制對象不同而有差別性,況且其中差異僅有專業人士才能辨別出,就消費者保護來說,並行兩道不同管制只會造成混淆,毫無益處。這也是為何當聯邦通訊委員會片面剝奪聯邦貿易委員會的管制權限而引發批評聲浪。對於寬頻提供者應保護隱私與資料安全之要求,應回歸至聯邦貿易委員會,由於國家對網際網路空間的管制,上網行為應該要適用一樣的規則,並且受到同樣的專責機關管制。除此之外,聯邦通訊委員會與聯邦貿易委員將共同合作致力於協調對寬頻提供者的隱私規範,該規範將會同所有與數位經濟相關的公司遵循的標準。線上世界技術中立(technology-neutral)的隱私框架之一致性,方能對消費者帶來最佳利益。 本次聯邦通訊委員會迅速暫停實施的隱私規範,顯現出美國對於保障隱私管制的重視性極高,美國針對網路生態中的不同公司,寬頻網路服務提供者及其他電信營運商,例如Comcast、Verizon、AT&T等;網站或其他邊緣服務商(edge service),例如Google、Facebook、Amazon等,將會有何種一致性的資料安全規範,值得持續關注。
從美國聯邦最高法院判決探討實用物品設計之著作權保護原則從美國聯邦最高法院判決探討實用物品設計之著作權保護原則 資訊工業策進會科技法律研究所 法律研究員 龔芳儀 107年8月25日 壹、事件摘要 運動服飾設計製造與銷售公司Varsity Brands, Inc.(後稱Varsity公司)擁有兩百餘件美國平面美術著作,而另一家運動服飾銷售公司Star Athletica, LLC(後稱Star公司)所販售之產品包含啦啦隊用品及啦啦隊服等。 Varsity公司於2014年向美國田納西州西區聯邦地區法院對Star公司提起著作權、商標權等侵權訴訟,本文將針對著作權爭議進行討論,Varsity公司控告Star公司於2010年的產品型錄與網站中所展示的啦啦隊服相似於其五件已註冊為美國著作之啦啦隊服設計,請參見圖一。 資料來源:JD Supra, LLC彙整 圖一 Varsity公司指出Star公司之啦啦隊服相似於Varsity公司已註冊為美國著作之啦啦隊服設計[1] Varsity公司所擁有之五件平面美術著作[2],如圖二所示,其中兩件(Design 299A與Design 299B)為啦啦隊服照片,另三件(Design 074、Design 078與Design 0815)為啦啦隊服之設計圖稿。被告Star公司認為Varsity公司之設計圖稿明顯是以啦啦隊服之輪廓進行設計,且當隊服缺乏設計時便成為空白之布料而失去啦啦隊服之功能,因此該些設計具有功能性,進而不符合美國著作權法第1302條第4項所指「設計之呈現僅為功能實現(dictated solely by a utilitarian function of the article that embodies it)」而不受保護之設計項目,即設計在作品上之呈現方式,僅展現功能性質,也就是說啦啦隊服上的圖樣設計為凸顯啦啦隊服功能,該些圖樣具功能性而不受著作權所保護。而Varsity公司主張設計師構思設計時並未被要求須考量啦啦隊服之功能、或實際製造之可行性,因此該設計不涉及功能性,而可受美國著作權法所保護。 資料來源:美國田納西州西區聯邦地區法院判決 圖二 Varsity公司之五件美國平面美術著作 美國田納西州西區聯邦地區法院法官[3]認為Varsity公司啦啦隊服可承受劇烈動作、吸汗等功能係屬於實用物品、且其顏色與設計在概念上無法從所依附的啦啦隊服分離,而認定該設計不被著作權法所保護,即Varsity公司所擁有之著作權無效,並在簡易法庭中認同Star公司之見解:啦啦隊員因穿著隊服而產生啦啦隊效果,使觀察者看到穿著啦啦隊服者而知道其為啦啦隊員,若少了啦啦隊服上的設計則失去啦啦隊意象,認為該啦啦隊服具備功能性而無法受著作權所保護,故Star公司無從侵害Varsity公司之五件平面美術著作。 本案經Varsity公司上訴,聯邦第六巡迴上訴法院於2015年推翻了一審法院判決[4],認為Varsity公司啦啦隊服上之設計為圖形設計[5]且可被分離、獨立於啦啦隊服,即圖形設計與啦啦隊服可各別存在,使該些設計可被著作權法所保護。 一、Varsity公司具有有效之著作權(ownership of a valid copyright) Varsity公司分別於2005年至2008年間於美國著作權局(Copyright Office)完成前述五件平面美術著作註冊,得以推定Varsity公司擁有原創著作。 二、Star公司所抄襲之元素為著作保護標的 針對證明Star公司是否抄襲,Varsity公司須考量Star公司在創作時是否以其著作當作創作模型之事實問題(a factual matter)、進而判斷受Star公司所抄襲之元素是否為著作保護標地之法律問題(a legal matter)。 上訴法院針對法律問題進行討論,列有分離性判斷原則之五個提問,並針對Varsity公司設計之分離性進行分析,如表一所示。 表一 以上訴法院分離性判斷原則比對Varsity公司之設計 上訴法院分離性判斷原則 比對Varsity公司之設計 (1)該設計是否屬「圖畫、圖形及雕塑著作」? Varsity公司之設計已取得平面美術著作註冊,係屬「圖畫、圖形及雕塑著作」 (2)若是,該設計是否為實用物品之設計? Varsity公司之設計係為啦啦隊服之設計,而該啦啦隊服為本質上具有實用性功能之物品,而非僅描繪(portray)該物品之外觀或傳達訊息(information) (3)實用物品之實用面為何? 啦啦隊服本質上之實用性功能為「覆蓋身體(cover the body)」即吸濕氣並承受運動員劇烈之動作 (4)一般設計觀察者是否能從實用物品之實用面辨識出圖畫、圖形及雕塑之設計特徵? 觀察者能辨識Varsity公司設計之圖形特徵,Varsity公司之客戶能從型錄中辨識不同圖形特徵之設計,即可從中挑選客製圖形設計 (5)實用物品之圖畫、圖形及雕塑設計特徵是否能獨立存在於實用物品之實用面? Varsity公司之設計師進行設計圖形特徵時,並未被要求考量啦啦隊服生產過程且該些設計具可換性(interchangeability),推斷圖形設計與啦啦隊服係可分離,可附於其他類型之服飾上,因此圖形特徵能獨立存在於啦啦隊服 資料來源:本研究彙整 另一方面,啦啦隊服之表面圖形設計是為織品設計(fabric design),如符合該分離性判斷標準則屬著作權法保護之範疇;相對地,隊服輪廓剪裁則具有遮蔽、包覆人體等功能係屬於服裝設計(dress design),該功能性則不受著作權保護。 Star公司不服上訴法院判決,本案於2016年進入美國聯邦最高法院[6],法官於2017年3月認同聯邦第六巡迴上訴法院見解,認為Varsity公司啦啦隊服之圖形設計與啦啦隊服可分離,並提出實用物品之設計在符合以下兩構件之分離性判斷原則,即為著作權所保護之標的範圍:(1)當設計特徵可被視成為平面或立體著作並且能與實用物品分離(can be perceived as a two- or three-dimensional work of art separate from the useful article);以及(2)若該設計特徵符合圖畫、圖形及雕塑著作(pictorial, graphic, and sculptural works, ”PGS works”),可被設想為可分離於實用物品,不管是獨立存在、或者依附於其他媒體上(either on its own or fixed in some other tangible medium of expression),即為著作權所保護之標的。 如表二,根據上述條件與Varsity公司之設計進行比對。Varsity公司啦啦隊服上之線條、圖紋、色塊等圖形設計係屬圖形著作,且該些圖形設計可從啦啦隊服分離,而可依附在其他媒體上、或獨立存在,因此該圖形設計為著作權法所保護之標的,Star公司確實侵害Varsity公司之五件平面美術著作。 表二 以聯邦最高法院分離性判斷原則比對Varsity公司之設計聯邦最高法院分離性判斷原則 聯邦最高法院分離性判斷原則 比對Varsity公司之設計 (1)當設計特徵可被視成為平面或立體著作並且能與實用物品分離。 Varsity公司啦啦隊服上之線條、圖紋、色塊等圖形設計係屬圖畫、圖形及雕塑著作中之圖形著作。 (2)若該設計特徵符合圖畫、圖形及雕塑著作(PGS works),可被設想為可分離於實用物品,不管是獨立存在、或者依附於其他媒體上,即為著作權所保護之標的。 該些圖形設計可從啦啦隊服分離,而可依附在其他媒體上、或獨立存在,如裝飾其他形式之服裝、或裱掛於牆上之圖形藝術,因此該圖形設計為著作權法所保護之標的。 資料來源:本研究彙整 貳、重點說明─實用物品設計是否為著作權標的,應分析與實用物品分離後之圖形設計而非物品本身 美國著作權法並未將屬實用物品之工業設計產品之設計納為保護標的,但工業設計不全是具功能之設計,當工業設計產品之設計附有藝術元素時,該保護界線便難以劃分。 對此,美國著作權法第101條[7](17 U.S.C.§101)提供實用物品之設計有限的著作權保護:當實用物品之設計具備圖畫、圖形及雕塑之藝術特徵(”pictorial, graphic, and sculptural features” of the “design of a useful article”),且該些特徵可被分離、或獨立存在於該物品之實用面(that can be identified separately from, and are capable of existing independently of, the utilitarian aspects of the article),應認為係屬圖畫、圖形或雕塑著作,該特徵便可受著作權法所保護。 進一步分析美國著作權法[8]所定義之實用物品(useful article)係指本質上具備固有的實用功能、並非僅是勾勒物品之外觀或資訊傳達(having an intrinsic utilitarian function that is not merely to portray the appearance of the article or to convey information)。 因此,判斷附於實用物品之藝術特徵是否適用著作權法,應就當實用物品除去藝術特徵後,該藝術特徵是否為著作權法所保護之標的。至於除去藝術特徵之實用物品則維持相似之實用性(remain similarly useful)即可,而非觀察當實用物品除去藝術特徵時是否喪失與原本相同之實用性(equally useful)[9],換言之,有無藝術特徵對實用物品的影響相對次要。 就本案而言,聯邦最高法院判斷啦啦隊服之圖形設計是否受著作權法所保護,並非針對當Varsity公司啦啦隊服移除圖形設計後,而使隊服不具備或削弱了啦啦隊意像而喪失與原本相同之實用性,就此認定該些設計具功能性、而不被著作權法所保護。據此,應將附有設計之Varsity公司啦啦隊服與未有裝飾設計之素白啦啦隊服兩者進行比較,兩啦啦隊服具有相似之實用功能,而針對該些啦啦隊服之設計係屬可分離於啦啦隊服之圖形著作,因此符合著作權法之保護標的。同時,聯邦最高法院根據上訴法院的觀點,敘明前述之判斷並不含括該啦啦隊服之剪裁及規格尺寸,其實質上係為功能設計,即非著作權法所保護之範圍。 參、事件評析 一直以來,實用物品之設計是否具可分離性而受著作權法所保護,美國法院未有一個共通的判決原則因此存在著不確定性,而本案釐清了判斷方法,並提供實用物品之設計是否為著作權法所保護之判斷原則。 如同過去法院或學者對於著作權標的所判斷關鍵,本判決仍著重於可分離性(separability),即設計是否能從實用物品分離,並且該設計可獨立存在或依附在其他物品上。而本判斷原則強調應針對分離後之設計而非物品進行討論,對應到本案即應討論啦啦隊服之設計而非啦啦隊服,即從啦啦隊服分離後之啦啦隊服設計係為圖形著作,屬著作權法之保護標的。 如此,除了讓既有的時尚產業對於服裝設計、布料裝飾等是否受著作權法保護有了較為明確的判斷方法,進而影響了工藝品、文創作品、甚至是逐漸大眾化之3D列印製品[10]等同時具備藝術設計與功能性之物品,其藝術設計特徵是否屬著作權法所保護之標的之辨別。 美國著作權保護標的之圖畫、圖形及雕塑著作,對應於台灣著作權法第5條第4項美術著作(含圖畫與雕塑)與第6項圖形著作,然而台灣著作權法對於實用物品等判斷似未見相關規範,對此美國聯邦最高法院對實用物品設計之可分離性所提出之判斷原則可作為參考。 此外,建議相關企業組織未來若在美國經營服飾、工藝品等銷售,透過美國著作權登記以取得該國著作權法第410條第(c)項[11]所規定享有著作權「初步證據-推定為著作權人」(prima facie)在訴訟上的實益,以及第412條[12]、第504條[13]與第505條[14]所規定之法定損害賠償及律師費用,以強化設計保護及爭訟過程中之主張。 針對服飾上之設計,除了透過著作權保護該些設計之概念表達外,亦可藉由設計專利保護具有設計之服飾,即保護物品之全部或部分之形狀、花紋、色彩或其結合,透過視覺訴求之創作。著作權保護不具功能性之創作表達,而設計專利則針對實體物之外觀設計進行保護;因此當設計本身擁有不具功能性的創作表達、且物品設計外觀符合產業上利用性、新穎性及創作性等設計專利要件,即可同時獲有專利法與著作權法之保護。 當該設計已具有識別性則可透過商標權保護,即藉由圖形、記號、顏色等設計組合產生足以使相關消費者認識其為表彰商品或服務之標識,當然會需要投入相對之行銷資源將該圖形、記號或顏色組合之設計讓大眾知悉且區別商品或服務來源。將設計透過商標保護之另一優點在於,該設計如果具有識別性,便不像設計專利一樣限於依附於特定物品如服飾上,還可將該設計申請註冊商標,指定使用於其他產品甚至服務類別上,更加發揮設計擴大應用。 企業組織可針對所產製之設計,規劃不同階段之智財保護策略,當創作完成時即享有著作權,建議可進行註冊登記將有助訴訟之舉證;當著作物為機械產製,且該些設計符合設計專利之要件時,可同時獲有專利法與著作權法之保護;最後,當行銷資源投入,使該設計逐漸具有識別性,進而可藉由商標註冊完善設計的各面向之智慧財產保護。 [1] JD Supra, LLC, Chevrons, Stripes, Cheerleaders, and Copyright: The Supreme Court Hears Oral Argument in Star Athletica v. Varsity Brands (2016), https://www.jdsupra.com/legalnews/chevrons-stripes-cheerleaders-and-94125/ (last visited Aug 26, 2018). [2] Varsity Brands, Inc. v. Star Athletica, L.L.C., No. 2:10-cv-02508, 2014 WL 819422, at *4 (W.D. Tenn. Mar. 1, 2014). [3] Varsity Brands, Inc. v. Star Athletica, L.L.C., No. 2:10-cv-02508, 2014 WL 819422, at *15 (W.D. Tenn. Mar. 1, 2014). [4] Varsity Brands, Inc. v. Star Athletica, LLC, 799 F.3d 468, 30 (6th Cir. 2015). [5] 17 U.S.C. § 102(a)(5) (2012). [6] Star Athletica, LLC v. Varsity Brands, Inc., 580 U.S. __, 17 (2017). [7] 17 U.S.C. § 101 (2012). [8] 17 U.S.C. § 101 (2012). [9] Star Athletica, LLC v. Varsity Brands, Inc., 580 U.S. at 13. [10] Varsity Brands, Inc. v. Star Athletica, LLC., Brief of Amici Curiae Formlabs Inc., Matter and Form Inc., and Shapeways Inc. in Support of Petitioner, 2016WL537499. [11] 17 U.S. Code § 410 (c) In any judicial proceedings the certificate of a registration made before or within five years after first publication of the work shall constitute prima facie evidence of the validity of the copyright and of the facts stated in the certificate. The evidentiary weight to be accorded the certificate of a registration made thereafter shall be within the discretion of the court. [12] 17 U.S. Code § 412. [13] 17 U.S. Code § 504. [14] 17 U.S. Code § 505.
談電磁紀錄證據定義與方法-比較加拿大電子證據統一法與我國刑事訴訟法相關規定


