歐盟「藥品法規包裹法案」(Pharma Package)重點說明與簡析

歐盟「藥品法規包裹法案」(Pharma Package)重點說明與簡析
資訊工業策進會科技法律研究所
2025年09月10日
歐盟理事會(the Council of the European Union)於2025年6月4日就歐盟「藥品法規包裹法案」(Pharma Package)取得一致立場,且正與歐洲議會及歐盟執委會展開三方協商(trilogue),以共同研議最終立法版本[1]。法案預計於2026年初進行表決,若順利通過且加上過渡期,最快將於2028年正式施行,並可能重塑歐盟藥品市場之上市與投資規劃。
壹、背景摘要
有鑑於歐盟現行的藥品法規制度,自2004年修正後施行至今已逾20年,難以充分回應公共衛生需求、藥品可及性落差以及國際市場競爭等多重挑戰。因此,歐盟執委會(European Commission, EC)於2023年4月公布「藥品法規包裹法案」,旨在強化藥品供應鏈穩定性、提升藥品創新與競爭力,以建立更公平、具韌性與永續性的歐洲醫藥市場[2]。而2024年4月歐洲議會(European Parliament)[3]、2025年6月歐盟理事會亦分別提出不同版本,以促進歐洲整合為單一藥品市場。
本次改革對生技製藥產業影響深遠,為協助我國製藥產業在進入歐洲市場前先行掌握相關動向,以下將進行重點說明與分析。
貳、立法重點與比較
一、藥品監管保護期間之修正
在本次藥品法規包裹法案中,有關藥品監管保護期間之修正,為歐盟執委會、歐洲議會與歐盟理事會分歧最大,也是外界高度關注之核心重點。首先,現行歐盟新藥保護是由8年資料專屬保護期(Regulatory Data Protection, RDP)[4]與2年市場獨占期(Market Exclusivity, ME)所構成[5],若於資料專屬保護期間內取得新適應症可再延長1年市場獨占期,亦即保護期共為10~11年。
歐盟執委會則提議將資料專屬保護期縮短至6年,並搭配延長誘因機制,最多可再延長3年,條件包含:
1.滿足現有醫療需求可延長0.5年。
2.藥品在所有歐盟成員國上市可延長2年。
3.進行比較性臨床試驗可延長0.5年。
此外,不同於現行制度將新適應症延長1年納入市場獨占期,歐盟執委會則提議將此移至資料專屬保護期,因此合併原有2年市場獨占期後,保護期共為8~12年。
反之,歐洲議會則擬將資料專屬保護期調整為7.5年,並同樣設有延長誘因機制,但總延長上限至多1年,條件包含:
1.滿足現有醫療需求可延長1年。
2.進行比較性臨床試驗可延長0.5年。
3.在歐盟境內透過公私協力進行研發可延長0.5年。
若公司另取得比現有療法更有顯著臨床優勢之新適應症,則原有2年市場獨占期可再延長1年,合併計算後保護期共為9.5~11.5年。
而歐盟理事會則不同於歐盟執委會、歐洲議會,選擇將資料專屬保護期維持現行8年,但無法再延長。然而,市場獨占期則提議縮減為1年,但若符合特定條件則可再延長至2年,合併計算後保護期共為9~10年。條件包括:
1.滿足現有醫療需求。
2.產品含有新活性物質,並同時符合以下3項要件:
(1)上市許可申請具關聯性且有證據基礎的比較性臨床試驗結果作為支持。
(2)在一個以上的歐盟成員國內進行臨床試驗。
(3)申請人須證明已優先於歐盟申請上市許可,或於首次向歐盟以外地區提出申請後90日內完成歐盟上市申請。
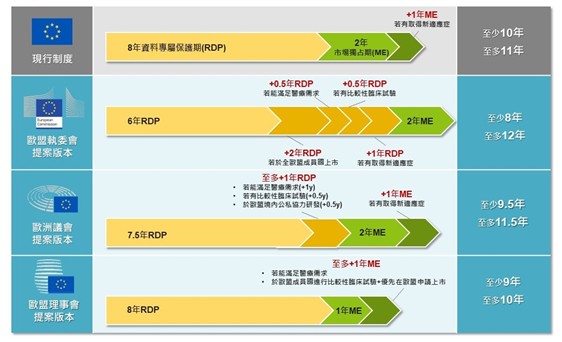
圖一、歐盟藥品法規包裹法案提議版本比較
資料來源:本研究整理
二、針對抗菌藥物引入創新研發機制
抗菌藥物抗藥性(Antimicrobial resistance, AMR)為近年全球公共衛生重要議題,並為世界衛生組織(World Health Organization, WHO)所列全球十大健康威脅之一[6]。因此,除嚴格限制抗菌藥物濫用外,為有效促進新型抗菌藥物之研發,本次藥品法規包裹法案中亦引入「可轉讓資料專屬保護權憑證」(Transferable Exclusivity Voucher, TEV)作為獎勵措施。
使用此憑證可賦予持有人額外1年資料專屬保護期,且除可用於抗菌藥品外,亦可適用於公司內其他更具商業價值藥品,或將此憑證轉賣給其他藥廠,為藥廠提供額外收入,但每張憑證僅能轉讓一次。
考量到憑證可能被用於商業利益龐大之藥品,藉此延緩學名藥與生物相似藥進入市場,並影響病患取得藥物之可及性,歐盟執委會於提議時亦強調此制度預計僅實施15年,或至多核發10張憑證後即停止適用[7]。此外,在歐盟執委會所提議之版本中,對於憑證使用亦設有限制,包含必須於憑證核發後5年內使用,且僅限用於尚在資料專屬保護期前4年之藥品,以確保市場可預測性。
歐洲議會與歐盟理事會雖然大致表態支持,但對憑證效力採取不同立場。歐洲議會態度較為保留,其提議使用憑證所額外延長之資料專屬保護期應依據抗菌藥品優先等級區分為6個月、9個月或12個月,且同樣受有總延長至多1年之限制。換言之,在歐洲議會提議版本下,無論延長事由為何,資料專屬保護期至多僅能延長至8.5年。
相對而言,歐盟理事會並未採納歐洲議會之提議,而是維持歐盟執委會提出增加1年資料專屬保護期之優惠設計。然而,為避免過度限制市場競爭,歐盟理事會亦新增規定,若憑證用於非抗菌藥品,則僅能在該藥品資料專屬保護期的第5年使用,且須證明過去4年內該藥品任一年銷售額均未超過4.9億歐元。
參、總結
「藥品法規包裹法案」反映出歐盟執委會、歐洲議會與歐盟理事會對新藥保護政策之差異,雖然三者皆試圖在鼓勵創新研發與提升藥品可近性之間取得平衡,但在藥品監管保護期間具體設計上仍有差異。歐盟執委會雖提議縮減資料專屬保護期,但也透過延長制度維持研發誘因。而歐洲議會則提議更高的初始保護門檻,但限制總延長期,且更著重在鼓勵研發活動而非市場擴張。至於歐盟理事會則維持現行保護年限,以持續激勵研發投入,但也透過縮短市場獨占期,加速學名藥與生物相似藥上市,以降低藥品價格並滿足醫療需求。
至於「可轉讓資料專屬保護權憑證」制度固然能為抗菌藥物提供研發誘因,但也伴隨著一定的潛在風險與利益分配爭議,如何確保該制度所帶來之公共利益超過公共衛生成本與風險,仍取決於未來最終立法版本應該如何調整與落實。對於我國製藥產業而言,此次改革有可能加速學名藥與生物相似藥進入歐洲市場,亦可能因延長誘因制度而遲延競爭時機,故仍應持續密切關注並審慎調整研發與市場策略。
[1]EUROPEAN COUNCIL, ‘Pharma package’: Council agrees its position on new rules for a fairer and more competitive EU pharmaceutical sector (2025), https://www.consilium.europa.eu/en/press/press-releases/2025/06/04/pharma-package-council-agrees-its-position-on-new-rules-for-a-fairer-and-more-competitive-eu-pharmaceutical-sector/#:~:text=The%20Council's%20position&text=obligation%20to%20supply%3A%20a%20new,patients%20in%20the%20member%20state (last visited Aug. 28, 2025).
[2]EUROPEAN COMMISSION [EC], Reform of the EU pharmaceutical legislation (2023), https://health.ec.europa.eu/medicinal-products/legal-framework-governing-medicinal-products-human-use-eu/reform-eu-pharmaceutical-legislation_en (last visited Aug. 28, 2025).
[3]EUROPEAN PARLIAMENT, Parliament adopts its position on EU pharmaceutical reform (2024), https://www.europarl.europa.eu/news/en/press-room/20240408IPR20308/parliament-adopts-its-position-on-eu-pharmaceutical-reform (last visited Aug. 28, 2025).
[4]「資料專屬保護期」是指專利藥提出新藥上市申請時,所檢附證明藥品安全性與療效之相關申請數據資料,其他藥廠非經原廠同意,於法定保護期間內不得引用,為行政機關針對原廠新藥上市申請資料給予之保護權益。詳請參考:台灣光鹽生物學苑,〈【醫藥小專欄】什麼是資料專屬權(data exclusivity)〉,台灣光鹽生物學苑,https://www.biotech-edu.com/%E3%80%90%E9%86%AB%E8%97%A5%E5%B0%8F%E5%B0%88%E6%AC%84%E3%80%91%E4%BB%80%E9%BA%BC%E6%98%AF%E8%B3%87%EF%A6%BE%E5%B0%88%E5%B1%AC%E6%AC%8A-data-exclusivity/ (最後瀏覽日:2025/08/28)。
[5]「市場獨占期」則是指在一定期間內,即使學名藥或生物相似藥已可向主管機關提出上市許可之申請並獲得核准,但仍不得實質上市銷售,須直到市場獨占期屆滿為止。市場獨占期與資料專屬保護期之比較,詳請參考:Specialist Pharmacy Service, Understanding data exclusivity and market protection (2025), https://www.sps.nhs.uk/articles/understanding-data-exclusivity-and-market-protection/ (last visited Aug. 28, 2025).
[6]〈世界抗生素週〉,衛生福利部疾病管制署,https://www.cdc.gov.tw/En/Category/MPage/t2VWXn93ooNVJPuQRF7jzg (最後瀏覽日:2025/08/28)
[7]CROWELL & MORING LLP, The New EU “Pharma Package”: The transferable exclusivity voucher—A comparison of Commission/Parliament/Council positions(2025),https://www.crowell.com/en/insights/client-alerts/the-new-eu-pharma-package-the-transferable-exclusivity-vouchera-comparison-of-commissionparliamentcouncil-positions (last visited Aug. 28, 2025).
所謂「大學共同利用機關法人」,係指日本於《國立大學法人法》(国立大学法人法)中,以設置大學共同利用機關為目的,依該法之規定設置之法人。而所謂「大學共同利用機關」,依該法之規定,則係指有關在該法所列舉之研究領域內,為促進大學學術研究之發展而設置,供大學院校所共同利用之實驗室。日本利用大學共同利用機關法人之設置,將大型研發設施設備,以及貴重文獻資料之收集及保存等功能賦予大學共同利用機關,並將其設施及設備,提供予與該大學共同利用機關進行相同研究之大學教職員等利用。 目前登錄於日本文部科學省之大學共同利用機關法人包括了「大學共同利用機關人類文化研究機構」(大学共同利用機関法人人間文化研究機構)、「大學共同利用機關自然科學研究機構」(大学共同利用機関法人自然科学研究機構)、「大學共同利用機關高能量加速器研究機構」(大学共同利用機関法人高エネルギー加速器研究機構),以及「大學共同利用機關資訊與系統研究機構」(大学共同利用機関法人情報・システム研究機構)等四者。
Linux創辦人捍衛商標權Linux 創辦人 Linus Torvalds 決心捍衛自己的商標權,並堅稱其要求商標再授權是賠錢生意。 Torvalds 日前委託律師發函給澳洲的 90 家公司,要求他們取銷任何 Linux 名稱的使用,並應向 Linux 商標的授權單位 – 非營利組織 Linux Mark Institute 購買再授權。這些公司必需個別支付 200 美元到 5,000 美元,以取得 Linux 商標的再授權,導致部分開放原始碼社群成員指控 Torvalds 想藉 Linux 的成功大撈一筆。 Torvalds 否認他自己,或任何人因 Linux 商標的再授權而賺錢,因為法律成本遠高於授權費,而律師所發出的通知函,僅是維護一個商標的必要動作。 Torvalds 最近也被人指控偽善,某些開放原始碼社群宣稱他對軟體專利的批評,與他行使專利權的作為互相矛盾, Torvalds 本身並未就此回應。惟反歐盟軟體專利規定的活動領袖,最近還被譽為智慧財產領域最重要人物的 Florian Mueller 表示,商標及著作權與軟體專利不同,軟體專利是有利於反競爭陣營和無產品的敲詐者的有力工具,但著作權和商標大致上獎勵那些創造和銷售真正產品的人,不加區隔地反對智慧財產權,是違法且無意義的;其並警告「反智慧財產激進主義」對開放原始碼的形象有害,某些右翼政客也同意 Bill Gates 的觀點,認為限制智慧財產權等於是共產主義,因此開放原始碼社群有必要將自己和反智慧財產權的觀點脫鉤。
澳洲發布「健康隱私指引」以降低健康資料之隱私風險澳洲隱私保護辦公室(Office of the Australian Information Commissioner, OAIC)於2019年9月發布「健康隱私指引」(Guide to health privacy)協助健康服務提供者了解及實踐相關規範所制定之隱私義務以確保個人資料安全。依據1988年澳洲隱私法(Privacy Act 1988)規定,健康服務指所有評估、維持、改善或管理個人健康狀況;或是診斷、治療或紀錄個人疾病或健康狀況之行為。而健康服務提供者除了醫院及醫療人員,更包含其他專業人員例如健身房及減肥診所、私立學校及托兒所、遠端醫療服務等所有涉及健康資料並提供健康服務之單位及人員。由於澳洲隱私法要求服務提供者必須積極建立、實施及維護隱私合法處理程序,為了協助所有健康服務提供者確實遵守法定義務,以減少健康資料之隱私風險問題,OAIC制定「健康隱私指引」提出八大步驟要求健康服務提供者確保遵守義務並保障所持有之個人資料: 制定並實施隱私管理計畫,確保遵守澳洲隱私原則(Australian Privacy Principles, APPs)。 制定明確的責任制以進行隱私管理,並及時提供員工幫助與指導。 建立個人資料檔案紀錄,以確認持有之個人資料。 了解法律規範之隱私義務並實施法定流程以履行義務。 定期舉辦員工隱私培訓課程以強化團隊基礎知識。 建立隱私權政策並於網頁上呈現或是提供手冊說明相關內容。 保護所持有之資料不被濫用、遺失或未經授權的修改及揭露等。 制定資料外洩因應措施,針對資料外洩進行危機處理。
聯合國教科文組織發布《人工智慧倫理建議書》草案聯合國教科文組織於2020年9月發布《人工智慧倫理建議書》草案(First Draft Of The Recommendation On The Ethics Of Artificial Intelligence)(下稱建議書),以全球性的視野與觀點出發,為第一份全球性關於人工智慧倫理的建議書,試圖對人工智慧倫理作出框架性規定,對照其他區域性組織或個別國家人工智慧倫理準則或原則,著重之處稍有差異。該建議書係由組織總幹事Audrey Azoulay於2020年3月任命24位在人工智慧倫理學方面之跨領域專家,組成專家小組(AD HOC EXPERT GROUP, AHEG),以《建議書》的形式起草全球標準文書。 其主要內容提到六大價值觀:(一)人性尊嚴(Human dignity)、(二)基本人權和自由(Human rights and fundamental freedoms)、(三)不遺漏任何人(Leaving no one behind)、(四)和諧共生(Living in harmony)、(五)可信賴(Trustworthiness)、(六)環境保護(Protection of the Environment)。其中尤值關注處在於,建議書除強調人工智慧的技術、資料及研究需要進行全球範圍的共享外,相當重視世界上所有的國家及地區在人工智慧領域是否能均衡發展。特別在六大價值觀中提出「不遺漏任何人」觀點,也同時呼應了聯合國永續發展目標(Sustainable Development Goals, SDGs)的倡議。在人工智慧技術發展過程中,開發中國家(global south)及相對弱勢的群體是相當容易被忽略的。人工智慧蓬勃發展的時代,若某些群體或個體成為技術弱勢者,不僅在技術發展上有落差,更可能使人工智慧系統容易產生歧視、偏見、資訊和知識鴻溝,其後更將導致全球不平等問題的挑戰。 由專家小組起草的建議書草案已於2020年9月提交給聯合國成員國,作為對建議書的初步報告。該報告將提供給各會員國,並同步提交給預定於2021年召開的政府專家委員會,最後預計於2021年底的提交聯合國教科文組織大會。



